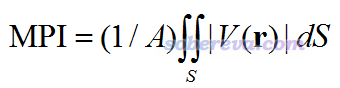| 談?wù)勅绾魏饬糠肿拥臉O性 | 您所在的位置:網(wǎng)站首頁 › 2022屬猴的和屬豬的合不合 › 談?wù)勅绾魏饬糠肿拥臉O性 |
談?wù)勅绾魏饬糠肿拥臉O性
|
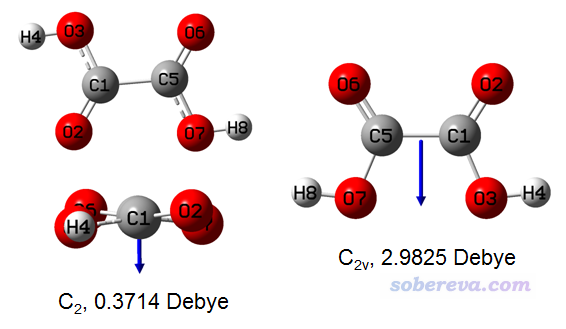
談?wù)勅绾魏饬糠肿拥臉O性 The way of measuring molecular polarity 文/Sobereva@北京科音 First release: 2019-Oct-16? Last update: 2020-Sep-29 0 前言經(jīng)常有人問怎么衡量分子的極性,是不是算個偶極矩就可以。實際上,極性是一個非常含糊的概念。從本質(zhì)上來說,極性來自于凈電荷分布的不均勻性,不均勻性越大則極性越強,而分布完全均勻就沒有極性。至于極性這個概念怎么才能嚴(yán)格定量反映出來,這沒有唯一答案,不同方式考察得到的結(jié)論可能大相徑庭。本文就專門說說如何衡量分子的極性。本文首先介紹一下從理論計算和實驗上有哪些方法可以衡量分子極性,最后一節(jié)用具有代表性的分子對不同方法進(jìn)行對比,討論什么指標(biāo)在衡量極性時相對而言更有意義、更靠譜。對比體現(xiàn)出Multiwfn程序可以計算的分子極性指數(shù)(Molecular polarity index, MPI)在衡量分子極性時比較有實用性,值得讀者在實際研究中采用。 1 從偶極矩角度衡量極性一提起怎么衡量分子的極性,絕大多數(shù)人首先想到的就是計算偶極矩。確實偶極矩是最常被用來衡量分子極性的指標(biāo),比如去Google搜搜molecular polarity,看到的資料幾乎都是拿偶極矩說事。偶極矩可以非常方便地通過量子化學(xué)計算準(zhǔn)確得到,很多情況下也確實能體現(xiàn)出極性的大小,它本質(zhì)上體現(xiàn)體系正電荷中心和負(fù)電荷中心的分離情況。比如偶極矩的順序是水>一氯甲烷>甲烷,因此我們說這三個分子極性遞減,這沒錯。 然而,需要注意的是,哪怕是小分子,在很多情況下用偶極矩來體現(xiàn)極性也會有嚴(yán)重誤導(dǎo)性。我們看下面的草酸體系,圖里給了B3LYP/def-TZVP下優(yōu)化出的兩種能量極小點構(gòu)型(左側(cè)的兩個是不同的視角),在B3LYP/def2-TZVPD下算的偶極矩也給出了(計算時沒考慮溶劑效應(yīng)),箭頭指示了偶極矩方向,朝向是負(fù)電荷中心指向正電荷中心
由常識都知道,羧基是個極性基團(tuán),草酸這么小的體系還有倆羧基,顯然它應(yīng)該是極性分子。然而從上圖左邊構(gòu)象的偶極矩來看,由于數(shù)值極小,草酸幾乎是非極性分子,這結(jié)論顯然不對。另外,上圖的右邊的構(gòu)象比左邊構(gòu)象的偶極矩大非常多,充分體現(xiàn)出對于極性分子,偶極矩是有嚴(yán)重的構(gòu)象依賴性的。 尤其是對于大分子,更是不能隨便拿偶極矩說事。下面是一個分子的三個不同構(gòu)象,分子是D7h點群
此體系里電負(fù)性中等的碳和高電負(fù)性的氧、氮元素交錯排列,從基本常識就知道肯定這個體系里原子電荷正負(fù)交替特征非常明顯,理應(yīng)認(rèn)為是有高度極性特征的。然而,由于體系的對稱特征,在垂直于環(huán)方向偶極矩精確為0,平行于環(huán)的方向偶極矩也非常小,因此拿偶極矩來衡量此體系的極性明顯不妥。 不光偶極矩衡量上面這種高對稱性體系的極性不適用,對于許多大分子,比如蛋白質(zhì)、糖、核酸也都不適用。可以認(rèn)為這些體系都有明顯的“局部極性”,用局部片段的偶極矩可以衡量這種局部極性,而如果直接用整體的偶極矩來說明分子整體極性就很不妥了,因為局部偶極矩會有互相抵消。往往大體系的很多地方局部極性很大,但整體的偶極矩卻不大,沒法正確反映體系是高極性分子的事實。此外,如果大家了解電多極展開的話,就知道體系的電荷分布可以展開為單極矩(即體系凈電荷)+偶極矩+四極矩+八極矩+十六極矩...一直到無窮階。對于凈電荷為0的體系,偶極矩相當(dāng)于只是體系電荷分布的最低階近似。對于大體系,光拿偶極矩反映電荷分布并討論,顯然太糙了。 另外,對于帶電體系,用偶極矩大小衡量極性總是無意義的。因為這種情況下偶極矩的大小是決定于體系原點的選擇的。換句話說,把體系整體平移一下,算出來的偶極矩就會出現(xiàn)變化,但顯然平移對于分子的極性從原理上是沒有內(nèi)在影響的。 所以,什么時候能用偶極矩來衡量極性?答案是:中性小體系,并且體系里高極性局部區(qū)域間的極性相互抵消不是特別顯著的情況。比如像乙醛、丙醇、乙醚、乙腈、甲酰胺等等都適用。 值得一提的是,想算準(zhǔn)偶極矩的話基組必須帶彌散函數(shù)。圖便宜的話可以用def2-SVPD,圖準(zhǔn)的話可以用上面我用的def2-TZVPD,這倆基組在此文里都有介紹:《給ahlrichs的def2系列基組加彌散的方法》(http://sobereva.com/340)。強烈不推薦Pople系列基組加彌散函數(shù)后用來算偶極矩(如6-311+G**),效果很差。至于理論方法,用B3LYP、PBE0都可以,不昂貴而計算偶極矩精度又不錯。 2 關(guān)于用四極矩討論無偶極矩體系的極性前述的電多極展開里,高于偶極矩的項我們這里稱作多極矩。比偶極矩更高一階的四極矩我覺得值得在這里順便說一下。Gaussian做完單點等任務(wù)的計算后,末尾不僅輸出偶極矩,也會給出包括四極矩在內(nèi)的多極矩。四極矩是個3*3矩陣,Gaussian給出的四極矩有兩種形式,彼此可相互變換。其中一種是Traceless Quadrupole moment(無跡的四極矩),即它的跡(三個對角元加和)為0。對于這種四極矩,體系在X/Y/Z上哪個方向電荷延展程度相對來說越高,它的XX/YY/ZZ中哪個分量就越大,因此可以反映出體系電荷分布偏離球?qū)ΨQ程度。 苯和環(huán)己烷(椅式)都有六個碳原子,都是偶極矩為0的體系,從偶極矩上完全體現(xiàn)不出它們的極性差異,但實際上從四極矩的角度來看,它們的極性并不同。下面是在B3LYP/6-31G*下優(yōu)化后用B3LYP/def2-TZVPD算的無跡的四極矩在垂直于環(huán)方向的分量,以及無跡的四極矩的大小|Θ|,即XX、YY、ZZ分量的平方和開根號,單位是Debye*?。
由|Θ|可見,環(huán)己烷的電荷分布偏離球?qū)ΨQ程度明顯低于苯,即電荷分布更為均勻。因此從四極矩的角度,我們可認(rèn)為環(huán)己烷的極性低于苯。我們還看到苯的無跡四極矩ZZ分量是個明顯的負(fù)值,這體現(xiàn)出苯的電荷分布在垂直于環(huán)平面的方向上顯著收縮;由于電子帶的是負(fù)電荷,因此這等價于說在垂直于環(huán)平面方向上電子分布的延展程度高于在苯環(huán)平面的方向,這是苯環(huán)上豐富的pi電子云導(dǎo)致的。 有很多體系,比如甲烷等Td點群的體系,|Θ|精確為0。如果想通過電多極展開考察它們的極性,就得考察八極矩了,但這就相當(dāng)抽象了。 總的來說,一般很少有機會拿四極矩去衡量分子的極性,像本節(jié)的例子那樣適合用四極矩說事的情況并不多。也就是對于一些無偶極矩的小體系,非要通過電多極分析對比極性高低的話可以祭出四極矩。 順帶一提,筆者之前有篇文章J. Mol. Model., 19, 5387 (2013),通過靜電勢和四極矩的角度討論了無偶極矩的兩個分子H2和N2的分子間相互作用,很推薦看看。對于無偶極矩的分子,其四極矩的大小明顯影響它與其它分子的靜電作用強度。在《靜電效應(yīng)主導(dǎo)了氫氣、氮氣二聚體的構(gòu)型》(http://sobereva.com/209)也對這篇文章內(nèi)容進(jìn)行了介紹。 3 從分子表面靜電勢分布特征衡量分子極性靜電勢是由體系電荷分布直接決定的,靜電勢對于考察分子間靜電相互作用、預(yù)測分子凝聚相性質(zhì)等方面有重要意義,不了解者參看此貼里的資料和其中列出的我的相關(guān)博文:《靜電勢與平均局部離子化能綜述合集》(http://bbs.keinsci.com/thread-219-1-1.html)。分子中電荷的不均衡分布會體現(xiàn)在分子表面的靜電勢分布上,因此對分子表面靜電勢分布特征進(jìn)行表征,就可以對分子的極性進(jìn)行衡量。下面說的分子表面用的是Bader用電子密度0.001 a.u.等值面定義的范德華表面。 為了能直接通過分子表面靜電勢分布特征衡量體系的極性,筆者定義了一個量,叫molecular polarity index(分子極性指數(shù)),簡寫為MPI,定義如下
其中V是分子靜電勢,積分是對分子表面S進(jìn)行積分,A是分子表面積。可以期望,MPI越大,分子的整體極性就越大。因為體系電荷分布不均勻性是分子極性的體現(xiàn),分布越不均勻就越會導(dǎo)致分子表面靜電勢出現(xiàn)很正或者很負(fù)的區(qū)域,從而使得MPI較大。上式的表達(dá)式是積分形式表達(dá)的,實際上Multiwfn在計算的時候是基于構(gòu)成分子表面的頂點及對應(yīng)的三角來算的,算法詳見筆者寫的J. Mol. Graph. Model., 38, 314 (2012)。 注:值得注意的是,即便體系電荷分布絕對均勻,分子表面靜電勢也并非精確為0。比如一個Ar原子,是嚴(yán)格非極性的,因為電子密度分布完全球?qū)ΨQ,但在不同電子密度等值面上靜電勢的數(shù)值是不同的。在B3LYP/6-31G*級別下,Ar的電子密度0.001 a.u.表面上MPI是1.37 kcal/mol。因此MPI=0并不是極性的零點,但這不影響在不同分子之間橫向?qū)Ρ萂PI來比較極性的差異。 另外筆者還定義了分子極性表面積,即靜電勢絕對值大于10 kcal/mol的面積,以及分子非極性表面積,即靜電勢絕對值小于10 kcal/mol的面積。容易理解,對于中性分子,分子極性表面積占總表面積百分比越大,理應(yīng)認(rèn)為分子的極性越大。之所以用10 kcal/mol作為標(biāo)準(zhǔn),一方面是其數(shù)值比較“整”,另一方面是像烷烴這種典型的非極性分子的范德華表面上不會有靜電勢絕對值超過這個范圍的地方(從后文表格里分子的Vmin和Vmax可以看到這一點)。 如果MPI在你的文章中被使用,除了要按照Multiwfn啟動時的提示引用Multiwfn程序本身的原文外,也請同時引用筆者的論文Carbon, 171, 514-523 (2021),這是第一篇包含MPI指數(shù)的公開發(fā)表的論文,在《全面探究18碳環(huán)獨特的分子間相互作用與pi-pi堆積特征》(http://sobereva.com/572)中對此論文還做了專門的解讀和評述,文中用MPI指數(shù)考察了獨特的18碳環(huán)體系的分子表面靜電勢,分析了與其它分子作用的特征。如果要引用筆者對極性和非極性表面積的定義,請引用Multiwfn手冊,格式如:Tian Lu, Multiwfn Manual, version 3.7, Section 3.15.1, available at http://sobereva.com/multiwfn (accessed Sep 29, 2020)。 上述的這些量用Multiwfn的定量分子表面分析功能做表面靜電勢分析后就可以直接輸出出來。程序可以在http://sobereva.com/multiwfn免費下載。Multiwfn的基礎(chǔ)知識見《Multiwfn FAQ》(http://sobereva.com/452),定量分子表面分析功能的基本使用見http://sobereva.com/159,可以用的輸入文件和產(chǎn)生方式見《詳談Multiwfn支持的輸入文件類型、產(chǎn)生方法以及相互轉(zhuǎn)換》(http://sobereva.com/379)。
下面舉一個例子,對計算乙胺的上述量。啟動Multiwfn,輸入 ethylamine.fch? //用B3LYP/def2-SVP優(yōu)化,之后B3LYP/def2-TZVP算單點產(chǎn)生的文件 12? //定量分子表面分析 0? //開始分析。默認(rèn)分析的是靜電勢在0.001 a.u.電子密度等值面上的分布特征 然后可以看到一大堆信息: ?Volume:?? 565.17983 Bohr^3? (? 83.75103 Angstrom^3) ?Estimated density according to mass and volume (M/V):??? 0.8939 g/cm^3 ?Minimal value:??? -37.25348 kcal/mol?? Maximal value:???? 23.19198 kcal/mol ?Overall surface area:???????? 359.52687 Bohr^2? ( 100.67779 Angstrom^2) ?Positive surface area:??????? 281.16492 Bohr^2? (? 78.73421 Angstrom^2) ?Negative surface area:???????? 78.36195 Bohr^2? (? 21.94358 Angstrom^2) ?Overall average value:??? 0.00375931 a.u. (????? 2.35900 kcal/mol) ?Positive average value:?? 0.01186119 a.u. (????? 7.44301 kcal/mol) ?Negative average value:? -0.02531045 a.u. (??? -15.88256 kcal/mol) ?Overall variance (sigma^2_tot):? 0.00044428 a.u.^2 (?? 174.94388 (kcal/mol)^2) ?Positive variance:??????? 0.00007670 a.u.^2 (???? 30.20141 (kcal/mol)^2) ?Negative variance:??????? 0.00036758 a.u.^2 (??? 144.74248 (kcal/mol)^2) ?Balance of charges (nu):?? 0.14283204 ?Product of sigma^2_tot and nu:?? 0.00006346 a.u.^2 (?? 24.98759 (kcal/mol)^2) ?Internal charge separation (Pi):?? 0.01314447 a.u. (????? 8.24829 kcal/mol) ?Molecular polarity index (MPI):?? 0.40252623 eV (????? 9.28248 kcal/mol) ?Nonpolar surface area (|ESP| 10 kcal/mol):???????? 32.56 Angstrom^2? ( 32.34 %) 可見體系總面積是100.67埃^2,MPI是9.28 kcal/mol,非極性表面積是68.12埃^2(占總表面積67.66%),極性表面積是32.56埃^2(占總表面積32.34%)。其它指標(biāo)的定義和實際意義看手冊3.15.1節(jié)。可見用Multiwfn計算這些指標(biāo)相當(dāng)方便。如果計算靜電勢時讓Multiwfn自動調(diào)用cubegen(做法見http://sobereva.com/435),計算很大的體系也花不了多少時間。 4 從實驗角度衡量分子極性除了偶極矩外,還有不少可觀測的分子性質(zhì)和它的極性有密切關(guān)系,因而可以在一定程度上衡量極性,這里說一些。 溶解自由能的定義和計算方法在《談?wù)勲[式溶劑模型下溶解自由能和體系自由能的計算》(http://sobereva.com/327)里有詳述。大家都知道相似相溶原理,極性-極性分子間,以及非極性-非極性分子間容易互溶,而極性和非極性分子間難以互溶,極性差異越大則通常越難互溶。A溶質(zhì)在B溶劑中越容易溶,則A在B溶劑中的溶解自由能就往往越負(fù)。因此,我們可以計算不同分子在水當(dāng)中的溶解自由能,由于水的極性極大,因此溶解自由能越負(fù),可以認(rèn)為分子的極性越高,反之溶解自由能越正,則可認(rèn)為分子的極性越低。順帶一提,諸如SMD這樣的常用的溶劑模型,溶解自由能是分為極性和非極性兩部分貢獻(xiàn)的,前者體現(xiàn)溶質(zhì)-溶劑之間的靜電、極化作用導(dǎo)致的自由能降低,因此產(chǎn)生負(fù)貢獻(xiàn),而后者則體現(xiàn)其它效應(yīng),貢獻(xiàn)可正可負(fù)。對于極性不很小的分子,在水中的溶解自由能的極性部分總占主導(dǎo),使得數(shù)值為負(fù)。而極性特別小的分子,諸如烷烴,極性部分負(fù)貢獻(xiàn)很小,而非極性部分此時是正貢獻(xiàn),導(dǎo)致在水中的溶解自由能為正。由于溶劑與溶質(zhì)處處發(fā)生作用,體系的各個區(qū)域都對溶解自由能有貢獻(xiàn),效果會以類似于標(biāo)量和的方式累加,因此用溶解自由能方式判斷極性時并不會像用偶極矩那樣會由于結(jié)構(gòu)的空間排列原因產(chǎn)生抵消(類似矢量和)。但這也帶來一個問題,也就是如果體系有多個極性基團(tuán)時,溶解自由能體現(xiàn)的不是體系的平均極性,比如丙三醇的溶解自由能遠(yuǎn)高于甲醇,但如果說丙三醇的極性高于甲醇是不妥的。后面有例子會體現(xiàn)這一點。 相對介電常數(shù)(eps)與分子的極性有密切關(guān)系。通常極性越高的分子的介電常數(shù)越高,比如水在標(biāo)況下eps達(dá)到78;極性越低的分子通常介電常數(shù)越低,比如環(huán)己烷的eps僅有2.0。原因在于eps體現(xiàn)的是介質(zhì)導(dǎo)致靜電作用的衰減,對于極性分子構(gòu)成的液體,加電場會導(dǎo)致其中的分子朝向被極化,它們產(chǎn)生的反方向的電場會一定程度抵消外電場,致使靜電作用比在真空中衰減得更快。不過介電常數(shù)雖然也可以通過分子動力學(xué)等方式模擬,但終究比較麻煩,精度往往也不是很好(取決于力場和模擬設(shè)定),而且和偶極矩一樣對衡量大分子極性也不適用(局部極性會相互抵消),因此不是很建議用eps來衡量極性。 溶質(zhì)的電子基態(tài)和激發(fā)態(tài)的極性是不同的,比如孤對電子到反pi軌道類型的激發(fā),激發(fā)態(tài)的極性是小于基態(tài)的。由于溶劑對兩個態(tài)穩(wěn)定化程度不同(極性越大的溶劑令極性越大的態(tài)能量降低越多),因此溶劑下和真空下的激發(fā)能是不同的。對于基態(tài)到特定的某個激發(fā)態(tài)的躍遷,溶劑的極性越大,會導(dǎo)致激發(fā)能改變越多。因此可以通過溶劑導(dǎo)致譜峰位移程度來衡量極性。https://sites.google.com/site/miller00828/in/solvent-polarity-table這個表格里的relative polarity就是根據(jù)溶劑令吸收峰位移得到的。用這種方式衡量極性確實是合理的,但必須做實驗。雖然理論計算也可以計算不同溶劑下的光譜,但是在隱式溶劑模型下算光譜時需要給出介電常數(shù),這又遇到了用eps衡量極性時的問題。 色譜法中樣品的保留時間和物質(zhì)極性也有密切聯(lián)系。在正相色譜中,流動相是非極性物質(zhì),極性小的物質(zhì)會先被洗脫下來,即保留時間較小,在譜圖前面出峰,而極性大的后被洗脫下來,在譜圖后面出峰。反相色譜則相反,流動相是極性物質(zhì),高極性的保留時間小。不過這只是一般規(guī)律,還有其它因素也會影響保留時間。 5 幾種衡量分子極性的參數(shù)的對比下面我給出我對一些比較有代表性的分子計算的一些前面提及的數(shù)據(jù),從而對比一下各種指標(biāo)對極性的衡量。要強調(diào)的是,沒法說哪一種指標(biāo)衡量極性是完全合理的,本來極性就是個含糊的概念,我們只能說哪種指標(biāo)相對而言更有實際意義、更靠譜、更有普適性。在我來看,一個合理的衡量極性的指標(biāo)應(yīng)當(dāng)能夠反映出整個分子的平均極性。 下面表格中μ是偶極矩,Atot是總表面積,pApolar是前述的極性表面積所占總面積百分比,Vmin和Vmax是分子表面靜電勢最小和最大點的數(shù)值。MPI是前述的分子極性指數(shù)。rel. pol.是前述的文檔里的relative polarity,eps是常溫下實驗測定的靜態(tài)介電常數(shù),ΔGsolv(water)是標(biāo)況下實驗測定的分子在水中的溶解自由能(前后都是1M標(biāo)準(zhǔn)態(tài))。有些單元格是空著的,要么是常溫下相應(yīng)分子是氣態(tài)本身就沒法測,要么是沒有查到。體系在B3LYP/def2-SVP下優(yōu)化,之后在B3LYP/def2-TZVP下得到波函數(shù),并使用2019-Oct-15更新的Multiwfn 3.7(dev)進(jìn)行分析得到靜電勢相關(guān)數(shù)據(jù)和表面積。偶極矩在B3LYP/ma-TZVP下得到(注:B3LYP/def2-SVP下草酸極小點是C2h點群,偶極矩精確為0)。優(yōu)化、單點、偶極矩計算時都沒有考慮溶劑模型。溶解自由能里藍(lán)字的是我用M05-2X/6-31G*結(jié)合SMD溶劑模型算的。
先看上表里的偶極矩。偶極矩確實能區(qū)分開一些分子的極性,比如高極性的水的偶極矩2.130遠(yuǎn)大于低極性的甲苯的偶極矩0.392。但是用偶極矩來衡量極性在很多情況下明顯不靠譜。草酸在前面已經(jīng)提了就不說了,從偶極矩的角度看,苯、環(huán)己烷、乙烷、乙烯、乙炔...的極性完全相同,顯然這是不科學(xué)的,其它指標(biāo)都指出它們的極性并不相同。從偶極矩的角度看,乙醇和正辛醇的極性幾乎沒有差別,前者和后者偶極矩分別是1.632和1.570,但由于正辛醇有一個很長的烴鏈,顯然應(yīng)當(dāng)認(rèn)為正辛醇的極性遠(yuǎn)低于乙醇才對。氯代乙烷的偶極矩2.192比氟化氫的1.947還大,若因此就認(rèn)為氯代乙烷比氟化氫的極性更大顯然是不對的,嚴(yán)重違背化學(xué)直覺。可見拿偶極矩衡量極性實在不可靠。 再看極性表面積占總表面積的百分比,pApolar。從數(shù)據(jù)可見對于靠偶極矩不能區(qū)分或不能正確區(qū)分極性的很多分子,靠這個指標(biāo)可以區(qū)分。例如水的81.6%明顯大于氯代乙烷的58.2%,乙炔(58.2%)>乙烯(22.6%)>乙烷(0%),乙醇(30.2%)>正辛醇(12.5%),等等,這都與極性關(guān)系次序準(zhǔn)確。但是靠這個指標(biāo)判斷也有一些不妥,比如氯代乙烷的58.2%比乙醇的30.2%大了近一倍,但乙醇的極性理應(yīng)不比氯代乙烷小那么多。 Vmin和Vmax本身不能用來衡量極性,但可以作為用其它指標(biāo)討論極性的時候的一個輔助。可以認(rèn)為分子具有很負(fù)的Vmin或很正的Vmax是體系具有較大極性的前提。眾所周知氟化氫、水的極性都很大,確實二者Vmin都很負(fù),同時Vmax都很正。而缺乏極性基團(tuán)的環(huán)己烷、辛烷、乙烷的Vmin和Vmax都比較接近于零。雖然氯代乙烷的pApolar高達(dá)58.2%,但由于其Vmin不算特別負(fù)而Vmax也不算特別正,因此不應(yīng)當(dāng)認(rèn)為其極性比pApolar為30.2%的乙醇高很多。由于Vmin和Vmax只體現(xiàn)分子表面上靜電勢最負(fù)和最正的兩個點的靜電勢情況,因此光靠Vmin和Vmax沒法說明分子整體極性情況,比如乙醇和正辛醇的Vmin和Vmax相仿佛,這是因為二者都有羥基,但正辛醇的很長的烴鏈拉低了體系的極性這點則沒有在此反映出來。 再來看筆者的MPI指數(shù)。由數(shù)據(jù)可見MPI用來衡量極性,總體上比較符合化學(xué)直覺(雖然少數(shù)極性順序可能有點違背直覺,但問題不顯著)。帶雜原子的體系給出的極性順序是水(22.8)≈HF(22.2)>草酸(18.8)>氯代乙烷(10.7)≈乙醇(10.1)≈乙胺(9.3)>正辛醇(6.1)≈乙醚(5.7)。給出的烷烴類極性順序是乙炔(12.0)>苯(7.9)≈甲苯(7.2)>=乙烯(6.5)>辛烷(2.8)≈乙烷(2.5)≈環(huán)己烷(2.4)。根據(jù)MPI,C60 (4.7)的極性介于乙烷和乙烯之間。乙炔的MPI數(shù)值不小,都已經(jīng)趕上乙醇了,這是因為繞著C-C三鍵有一大圈pi電子,導(dǎo)致很大一塊區(qū)域表面靜電勢都為負(fù),而乙炔里氫原子的電荷明顯比乙烯、乙烷里的大很多,導(dǎo)致乙炔兩端靜電勢明顯為正。 Relative polarity將水定義為了1。其給出的順序是苯>=甲苯>環(huán)己烷,以及乙醇>正辛醇>乙醚,都和MPI相同。但是這個指標(biāo)的分辨能力稍微差一些,比如正辛醇比乙醇長兩倍,長出來的部分都是極性很低的烴鏈,但前者和后者的Relative polarity分別是0.654和0.537,相差得沒有直覺上那么大。 靜態(tài)介電常數(shù)eps和MPI給出的極性順序比較一致。比如都是乙醇>正辛醇>乙醚>辛烷,也都指出苯和甲苯比環(huán)己烷極性更強。 表格里的分子在水中的溶解自由能有些和一般直覺上的極性相吻合,比如體現(xiàn)出水的極性最大,HF的極性也很大,并且體現(xiàn)極性順序:苯(-0.9)=甲苯(-0.9)>環(huán)己烷(1.2),乙炔(0.0)>乙烯(1.3)>乙烷(1.8)。但也有些不是那么符合直覺,比如氯代乙烷(-0.6)仿佛還沒有苯(-0.9)的極性大,乙醇(-5.0)和正辛醇(-4.1)區(qū)分度不高,乙烷(1.8)顯得比辛烷(2.9)極性更大并沒什么道理。草酸的溶解自由能-12.2比水都大一倍,原因在前面提到了,這是因為草酸有兩個羧基,對溶解自由能的貢獻(xiàn)有累加效果,如果光看數(shù)值就認(rèn)為草酸比水的極性更大顯然是不合適的。C60明顯是低極性分子,但算出來它在水中的溶解自由能-8.1比水分子在水中的溶解自由能還負(fù),若認(rèn)為C60的極性比水分子還高明顯不妥。之所以這么負(fù)是因為雖然C60局部極性不大,也就類似于苯,但由于與溶劑作用面積很大,因此溶解自由能很負(fù)。從這些數(shù)據(jù)來看,能用溶解自由能衡量分子極性的,也就是分子大小相仿佛,而且具有相同數(shù)目極性基團(tuán)的情況。 總的來說,沒有哪種指標(biāo)對所有體系都能100%給出完全符合直覺的極性順序,但相對來說,MPI指數(shù)對于絕大多數(shù)情況都表現(xiàn)較好,比較普適,而且計算非常容易,因此筆者建議拿它來衡量整體極性。 順帶一提,表格里有個陽離子體系,即乙胺陽離子。它的Vmin和Vmax都是非常大的正值,這是理所應(yīng)當(dāng)?shù)模驗殛栯x子體系通常分子表面的靜電勢都被它帶的正電荷所主導(dǎo),故通常靜電勢都是正的而且數(shù)值較大。它的MPI也遠(yuǎn)大于任何中性分子,在水中的溶解自由能也遠(yuǎn)比中性分子要負(fù)得多得多。因此如果要把離子體系和中性分子放到一起對比,那姑且可以認(rèn)為離子體系具有極大的極性。 |
【本文地址】
| 今日新聞 |
| 推薦新聞 |
| 專題文章 |